«12 месяцев». Синдром Линча. Часть первая: «Помогите отремонтировать ДНК»
Информационно-просветительский гуманитарный проект «12 месяцев» — это цикл материалов о необычных людях – пациентах с редкими (орфанными) болезнями, о которых не написано в студенческих учебниках. Считается, что вероятность встретить на профессиональном пути редкого пациента у обычного врача ничтожно мала, поэтому в академических аудиториях им не уделяют должного внимания, что в повседневной жизни приводит к диагностическим ошибкам, упущенному времени и поломанными судьбами и жизням. Проект «12 месяцев» реализуют студенты и ординаторы – будущие и нынешние специалисты, активно изучающие генетические методы диагностики, их место в современной врачебной работе. Материалы готовятся на кафедре патологической анатомии СЗГМУ им. И.И. Мечникова (Санкт-Петербург) при поддержке научно-практического журнала «Гены и Клетки», блога истории медицины и порталов Indicator.Ru и «Нейроновости». Каждый проект будет состоять из трех публикаций: рассказа о заболевании с видеотаймлайном его изучения, пациенткой истории и истории самого заболевания. Научные редакторы проекта — Алексей Паевский и Роман Деев. Четвертый цикл статей посвящен онкологическому заболеванию с генетической природой: синдрому Линча.
Синдром Линча – один из наиболее частых онкологичеких синдромов, передающихся из поколения в поколение. Если случайным образом отобрать из популяции 300 человек, то скорее всего, один из них будет обладателем мутаций характерных для этого синдрома. Нет, назван он не в честь режиссера сериала «Твин Пикс», а по имени американского врача и учёного Генри Томпсона Линча (1928-2019). Но здесь мы не будем останавливаться на истории изучения этого заболевания. Более подробно с этим вопросом вы можете ознакомиться в нашем ролике.
Скажем только, что Генри Т. Линча не зря называют «отцом генетики рака». Это неформальное звание он получил как первый врач, сумевший показать, что в развитии некоторых онкологических заболеваний главным пусковым фактором является не воздействие окружающей среды в виде канцерогенов (кстати, ГМО к ним не относятся), а то, что человеку досталось в наследство от родителей – ДНК – молекула, являющаяся основой для огромного количества сложнейших химических реакций, итогом которых являются клетки, ткани и органы всех живых организмов.
Перейдём к сути. Что же собой представляет синдром Линча? Можно сказать, что это передающаяся по наследству, то есть генетически обусловленная, повышенная вероятность развития рака. Причем рака определённой локализации и появляющегося в раннем (для рака) возрасте. К наиболее «излюбленным» синдромом Линча участкам организма относят матку (эндометрий), яичники, желудок, мочевыводящие пути, тонкую кишку, поджелудочную железу, желчевыводящие пути, сальные железы. Но главным его «фаворитом» является толстая кишка, где на долю синдрома Линча приходится 1 из 35 случаев рака в медицине, именуемого колоректальным. Неудивительно, что первым названием этого синдрома было «наследственный неполипозный колоректальный рак». С небольшим отставанием по распространенности синдрома следует рак эндометрия – 1 из 56 случаев.
Другой особенностью синдрома Линча является высокая частота появления одновременно или последовательно нескольких опухолей в разных органах. Теперь давайте разберёмся, какие нарушения происходят в человеческом организме при синдроме Линча и как они приводят к развитию рака? Начнём по порядку.
Элементарной единицей нашего организма является клетка – очень «умная» структура, которая способна сама и при помощи окружающих её коллег (тоже клеток, но немного отличающихся) решить, как и сколько ей жить, размножаться ей или умирать. Информационным центром клетки является генетический материал, который закодирован в ДНК в форме последовательности нуклеотидных оснований. То есть, «кодить» – это прерогатива природы, а не программистов. Размножаются клетки не в привычной для нас форме, они делятся на части. Перед этим молекула ДНК тоже разделяется на две части, которые затем достраиваются до состояния двойной спирали. Восстановление происходит за счет подбора к исходной половине подходящих нуклеотидных оснований. Но как в человеческой жизни, при копировании случаются ошибки, так и в жизни клетки без них не обходится. Поэтому при делении возможны нарушения кода ДНК, которые можно сравнить с опечатками при быстром наборе текста – где-то букву потеряли, где-то вставили, где-то другую напечатали. Но природа отнюдь не глупа, поэтому она придумала специальных «редакторов», призванных искать ошибки в ДНК и исправлять их. Этими «редакторами» являются белки, структура и функция которых определяется генами системы репарации ошибочно спаренных оснований ДНК (MMR – англ. MisMatch Repair). После каждого деления клетки, они, не щадя энергии, заложенной в АТФ, просматривают весь код ДНК и, обнаружив ошибку, объединяются, чтобы её исправить методом «вырезать – вставить». При повреждении генов, кодирующих эти белки, их функция нарушается, что приводит к накоплению «опечаток» в коде ДНК и последующим мутациям в генах, защищающих организм от опухолевого роста.


Так что же входит в систему MMR? Какие гены защищают нас от поломок ДНК? Их достаточно много, и все они рассматриваются как потенциальные мишени для мутаций при синдроме Линча. Но чтобы не перегружать вас информацией, мы укажем четыре главных представителя, а также наиболее частые для них локализации опухолей. Перед тем, как перейти к названиям, являющимся сложными аббревиатурами, которые задумчиво произносят на научных конференциях, но мало кто не помнит, как они расшифровываются, необходимо отметить, что все гены условно принято делить на «мажорные» и «минорные». Нет, «мажорные» гены не более веселые, а «минорные» не более грустные. В случае синдрома Линча разница заключается в том, что опухоли развиваются чаще при мутации представителей первой группы, чем второй.
Начнём с «мажоров». К ним относятся два гена, которые были идентифицированы в теперь уже далёком 1994 году – MSH2 и MLH1. Несмотря на их принадлежность к одной условной группе, проявления, вызванные их мутацией, разительно отличаются. Так, для дефекта MSH2 более частыми являются опухоли внекишечных локализаций (рак желудка, тела матки, яичников или почек), что не характерно для мутации MLH1. В последнем случае чаще развиваются именно опухоли ободочной кишки. «Минорными» мутациями, о которых мы хотели бы рассказать, являются MSH6 и PMS2. Для MSH6 «излюбленной» локализацией является структура, покрывающая матку изнутри – эндометрий. Интересно, что белки, кодируемые генами MSH2 и MSH6 для того, чтобы функционировать, должны соединиться (образовать димер). Учитывая, что для мутаций MSH2 частота развития опухолей выше, понятно, кто в этой парочке главный. Самой «приятной», насколько это возможно при синдроме Линча, является мутация гена PMS2. Для неё характерно менее частое развитие злокачественных новообразований, а главным её проявлением являются доброкачественные полипы толстой кишки.
Теперь, когда вы знаете, что такое синдром Линча и как он развивается, пора переходить к лечению. К сожалению, тут всё не так просто и радужно, как хотелось бы. То ли в связи с относительно недавним установлением природы этого синдрома, то ли из-за количества генов, задействованных в формировании этого тяжелого заболевания, никто пока не решается предпринять попытку воздействовать на причину – поломку в генах, отвечающих за ремонт ДНК. Тем не менее, некоторые группы препаратов, которые применяются в онкологии, у пациентов с синдромом Линча работают лучше, чем у других. Одной из таких групп являются ингибиторы иммунных контрольных точек.
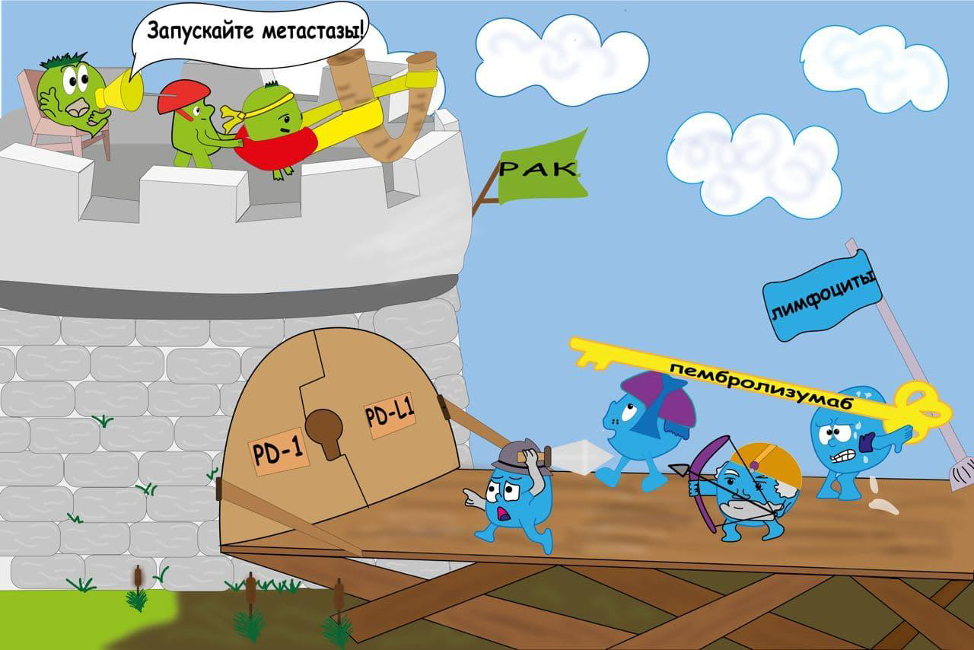
Всё дело в том, что в результате мутаций в опухолевых клетках появляются белки с измененной структурой, которые для нашего организма являются новыми. А наш организм не любит ничего нового, его ключевой задачей является поддержание постоянства своего состава (гомеостаза). Зачем добавлять что-то новое, если всё и так работает? Не очень умно в контексте эволюции, но зато более безопасно. Поэтому у нас функционирует отдельная система, ключевой задачей которой является поддержание гомеостаза – система иммунитета. Одной из её основных задач и является уничтожение всего нового и чужого. Но на удивление система иммунитета почему-то упорно игнорирует опухолевые антигены. Лучшие умы долго ломали голову в попытке выяснить причину, пока не поняли, что в основе толерантности к опухоли лежит способность её клеток нарушать активацию лимфоцитов.
Опять сложные слова, скажете вы - но мы сейчас всё объясним. Предположим, что у вас есть электрический прибор, который включается, когда его втыкаешь в розетку. Но тут у вас появились дети, и надо защитить их от попыток игр с электричеством. Для этого вы вешаете на розетки специальные заглушки, которые можно снять, только используя специальный ключ. В этой метафоре электрическим прибором является клетка иммунной системы, которая должна уничтожить опухолевую – чаще всего T-цитотоксический лимфоцит («цито» – клетка), а розеткой – межклеточное взаимодействие, в ходе которого иммунная клетка распознает «чужое» и активируется. Но как при репликации ДНК случаются ошибки, так и Т-лимфоциты могут не узнать клетку и попытаться её уничтожить. Поэтому мудрая эволюция придумала специальные «заглушки», которые инактивирует Т-цитотоксические лимфоциты, способные навредить организму – ими являются рецепторы программированной клеточной смерти (PD-R - англ. Programmed cell death – receptor). К сожалению, опухоли научились с их помощью защищаться от попыток системы иммунитета предотвратить раковый рост. Но как вы помните, чтобы снять заглушку, надо воспользоваться специальным ключом. Именно за открытие одного из первых таких «ключей» в 2018 году Джеймсу Эллисону и Тасуку Хондзе была присуждена Нобелевская премия по физиологии и медицине. Впоследствии эти «ключи» получили название «ингибиторы иммунных контрольных точек», а одним из наиболее распространенным их представителей стал пембролизумаб – препарат, который блокирует рецептор PD-1 и позволяет иммунному синапсу активировать T-цитотоксические лимфоциты.
С момента первого упоминания синдрома Линча прошло более века. За это время были достигнуты грандиозные успехи в диагностике и лечении связанных с ним злокачественных новообразований. Разработаны методы, позволяющие определить, есть ли поломка в генах MMR, и специальные критерии, помогающие врачу решить, кому из больных необходимо получить такое исследование. Эти критерии носят название Амстердамских. Согласно ним, высока вероятность наличия синдрома Линча, если у больного есть родственники с онкологическими заболеваниями, которые прослеживаются в нескольких поколениях, имеют характерные локализацию, строение и развиваются до 50 лет.
Прямо сейчас идёт работа по исследованию генома рака эндометрия – второй по распространённость локализации опухолей у пациенток с синдромом Линча. Генетические технологии становятся всё более эффективными и доступными. Ведутся работы над новыми методами выявления людей с высокой вероятностью развития рака. Возможно совсем скоро любой человек сможет оценить свой риск развития онкологического заболевания, просто сдав несколько анализов в ближайшем генетическом центре.
Текст: Юрий Слепов Иллюстраторы: Дана Макоева, Александра Снопченко